Η UCB ανακοινώνει την έγκριση του BIMZELX®▼(μπιμεκιζουμάμπη) από την Ευρωπαϊκή Επιτροπή, στη θεραπεία ενήλικων ασθενών με μέτρια έως σοβαρή Ψωρίαση κατά Πλάκας
H UCB, μία βιοφαρμακευτική εταιρεία με παρουσία σε όλο τον κόσμο ανακοίνωσε σήμερα ότι η Ευρωπαική Επιτροπή χορήγησε άδεια κυκλοφορίας στο BIMZELX® για τη θεραπεία της μέτριας έως σοβαρής Ψωρίασης κατά Πλάκας σε ενήλικους ασθενείς που είναι υποψήφιοι για συστηματική θεραπεία. Η μπιμεκιζουμάμπη είναι η πρώτη εγκεκριμένη θεραπεία για μέτρια έως σοβαρή Ψωρίαση κατά Πλάκας, που έχει σχεδιαστεί για να αναστέλλει επιλεκτικά τόσο την IL-17A όσο και την IL-17F, δύο βασικές κυτταροκίνες που καθοδηγούν τις φλεγμονώδεις διαδικασίες.
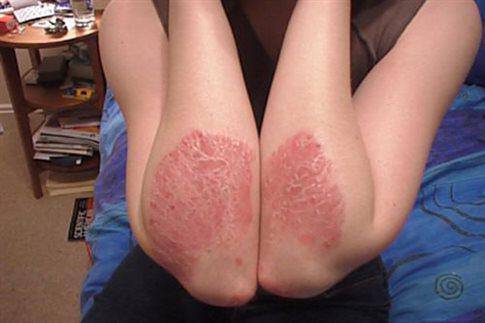
Η μπιμεκιζουμάμπη εγκρίθηκε με συνιστώμενη δόση 320 mg, χορηγούμενη από 2 υποδόριες ενέσεις κάθε 4 εβδομάδες μέχρι τη 16η εβδομάδα και στη συνέχεια κάθε 8 εβδομάδες .1 Για κάποιους ασθενείς με σωματικό βάρος άνω των 120 κιλών, που δεν έχουν πετύχει πλήρη κάθαρση δέρματος τη 16η εβδομάδα, η συνέχιση της θεραπείας με 320 mg κάθε 4 εβδομάδες μπορεί να βελτιώσει περαιτέρω τη θεραπευτική απόκριση .«Η έγκριση του BIMZELX στην Ευρώπη αποτελεί την πρώτη άδεια κυκλοφορίας που χορηγήθηκε για αυτήν τη νέα θεραπεία ψωρίασης παγκοσμίως και αντιπροσωπεύει μια σημαντική στιγμή για τη δερματολογική κοινότητα και τη UCB. Η φιλοδοξία μας είναι να βελτιώσουμε τη ζωή των ανθρώπων που ζουν με σοβαρές ασθένειες και είμαστε απίστευτα περήφανοι που προσφέρουμε μια νέα θεραπευτική επιλογή σε άτομα που ζουν με μέτρια έως σοβαρή Ψωρίαση κατά Πλάκας στην Ευρώπη. Πιστεύουμε ότι η μπιμεκιζουμαμπη έχει τη δυνατότητα να αυξήσει τις προσδοκίες για το τι μπορεί να προσφέρει μια θεραπεία ψωρίασης», είπε ο Emmanuel Caeymaex, Εκτελεστικός Αντιπρόεδρος Ανοσολογίας και επικεφαλής ΗΠΑ της UCB.

H ψωρίαση μπορεί να έχει σημαντικό σωματικό και ψυχολογικό αντίκτυπο στους ασθενείς, καθώς και να αποδειχθεί επιζήμια για την ποιότητα ζωής τους, επηρεάζοντας δυνητικά την εργασία, τις σχέσεις τους, την αναψυχή, αλλά και την κοινωνική και οικογενειακή τους ζωή. Μια έρευνα σε ασθενείς έδειξε ότι τουλάχιστον το 90% των ασθενών με μέτρια έως σοβαρή Ψωρίαση κατά Πλάκας αξιολογούν υψηλότερα μια θεραπεία που παρέχει καθαρό δέρμα, ανταπόκριση με διάρκεια και γρήγορη έναρξη δράσης Επιπρόσθετα, μια RWE μελέτη έδειξε ότι η απόκτηση εντελώς καθαρού δέρματος μπορεί να κάνει σημαντική διαφορά στον αντίκτυπο που έχει η ψωρίαση στην ποιότητα ζωής, που σχετίζεται με την υγεία των ασθενών.«Στις εγκριτικές μελέτες της Φάσης 3, οι ασθενείς που έλαβαν μπιμεκιζουμάμπη πέτυχαν ανώτερα επίπεδα κάθαρσης δέρματος σε σύγκριση με εκείνους που έλαβαν εικονικό φάρμακο, ανταλιμουμάμπη και ουστεκινουμάμπη, και στη μελέτη Φάσης 3b, η θεραπεία με μπιμεκιζουμάμπη πέτυχε καλύτερα επίπεδα καθαρού δέρματος από τη σεκουκινουμάμπη. Σε όλες τις μελέτες, περίπου το 60% των ασθενών που έλαβαν μπιμεκιζουμάμπη πέτυχαν πλήρη κάθαρση δέρματος τη 16η εβδομάδα και αυτή η ανταπόκριση διατηρήθηκε για έως και ένα χρόνο», είπε ο καθηγητής Richard Warren, του Salford Royal NHS Foundation Trust και του University of Manchester, UK. «Η έγκριση της μπιμεκιζουμάμπης στην Ε.Ε. αποτελεί μια ευπρόσδεκτη θεραπευτική επιλογή που θα μπορούσε να βοηθήσει περισσότερους ασθενείς με μέτρια έως σοβαρή Ψωρίαση κατά Πλάκας να επιτύχουν τους θεραπευτικούς τους στόχους».

Emmanuel Caeymaex, Εκτελεστικός Αντιπρόεδρος Ανοσολογίας και επικεφαλής ΗΠΑ της UCB.
Η έγκριση της Ευρωπαϊκής Επιτροπής ακολούθησε τη θετική γνωμοδότηση που εκδόθηκε τον Ιούνιο του 2021 από την Επιτροπή Φαρμάκων για Ανθρώπινη Χρήση του Ευρωπαϊκού Οργανισμού Φαρμάκων. Η έγκριση υποστηρίζεται από τα θετικά αποτελέσματα τριών μελετών Φάσης 3, οι οποίες αξιολόγησαν την αποτελεσματικότητα και την ασφάλεια της μπιμεκιζουμάμπης σε 1.480 ασθενείς με μέτρια έως σοβαρή Ψωρίαση κατά Πλάκας.1 Τα πλήρη ευρήματα από τις μελέτες Φάσης 3, BE READY και BE VIVID, δημοσιεύτηκαν στο The Lancet και τα αποτελέσματα της μελέτης Φάσης 3 BE SURE, δημοσιεύτηκαν στο The New England Journal of Medicine. Η έγκριση από την Ευρωπαϊκή Επιτροπή ισχύει και για τα 27 κράτη μέλη της ΕΕ, καθώς και για την Ισλανδία, το Λιχτενστάιν και τη Νορβηγία. Η μπιμεκιζουμαμπη βρίσκεται επί του παρόντος υπό εξέταση από την Αμερικανική Υπηρεσία Τροφίμων και Φαρμάκων (FDA) για τη θεραπεία ενηλίκων ασθενών με μέτρια έως σοβαρή Ψωρίαση κατά Πλάκας. Οι κανονιστικές αναθεωρήσεις βρίσκονται επίσης σε εξέλιξη στην Αυστραλία, τον Καναδά, τη Μεγάλη Βρετανία και την Ιαπωνία.
Διαβάστε όλες τις τελευταίες Ειδήσεις για την υγεία από την Ελλάδα και τον Κόσμο
Ακολουθήστε το healthweb.gr στο Google News και μάθετε πρώτοι όλες τις ειδήσεις
Ακολουθήστε το healthweb.gr στο κανάλι μας στο YouTube