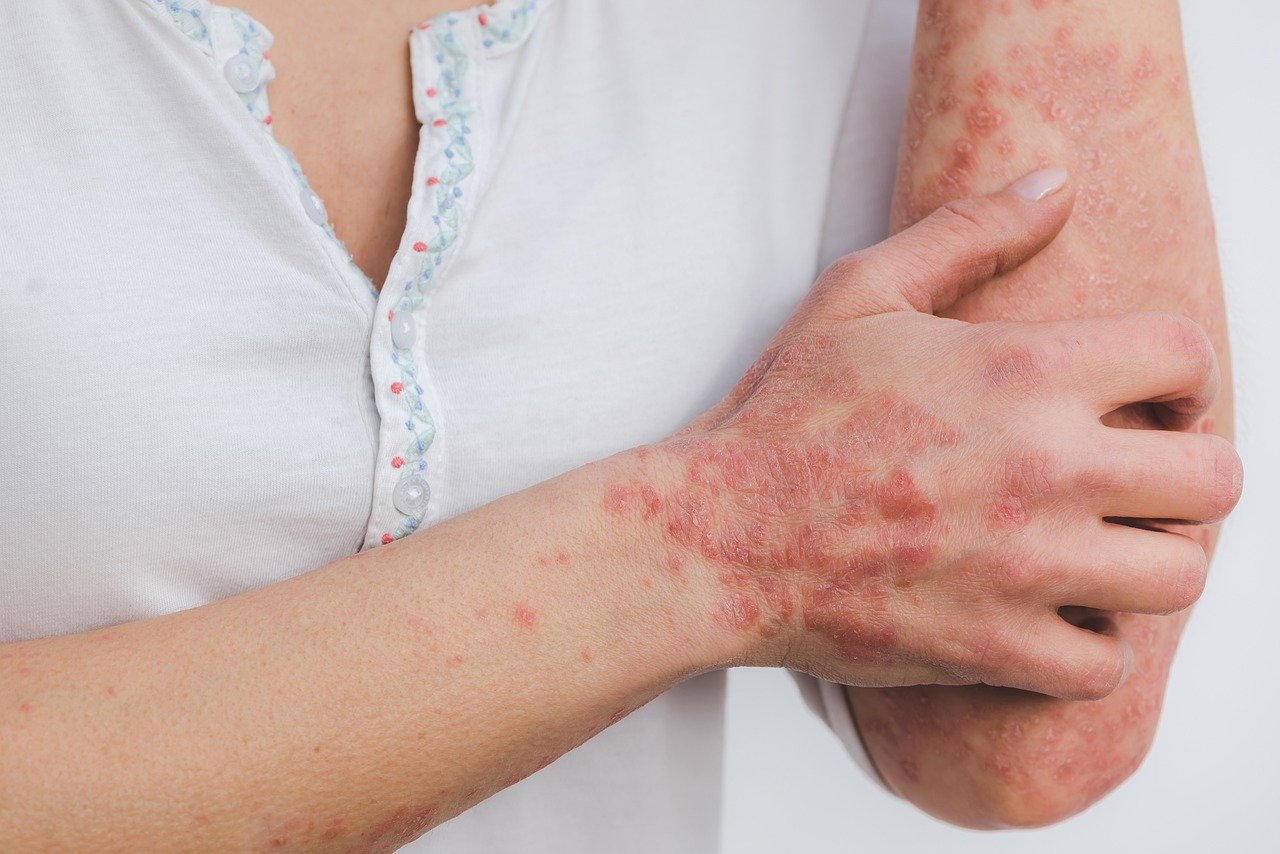
Ψωρίαση: H UCB, μία βιοφαρμακευτική εταιρεία με παρουσία σε όλο τον κόσμο ανακοίνωσε ότι η επιτροπή του Ευρωπαϊκού Οργανισμού Φαρμάκων (ΕΜΑ),CHMP, γνωμοδότησε θετικά για τη χορήγηση άδειας κυκλοφορίας για το BIMZELEX®* (bimekizumab), έναν υπό διερεύνηση εκλεκτικό αναστολέα των IL-17A και IL-17F, για τη θεραπεία ενηλίκων ασθενών με μέτρια ως σοβαρή Ψωρίαση κατά Πλάκας, που είναι υποψήφιοι για θεραπεία με συστηματική αγωγή.
Η UCB λαμβάνει θετική γνωμοδότηση από τον CHMP, που συνιστά την έγκριση του BIMZELEX®* (bimekizumab) στην ΕΕ για τη θεραπεία ενηλίκων με Μέτρια ως Σοβαρή Ψωρίαση κατά Πλάκας.

Η θετική γνωμοδότηση από τον CHMP υποστηρίζεται από δεδομένα 3 μελετών Φάσης 3, όπου το bimekizumab παρουσίασε ανώτερα επίπεδα επίτευξης καθαρού δέρματος από το εικονικό φάρμακο, το ustekinumab και το adalimumab. Εάν εγκριθεί από την Ευρωπαϊκή Επιτροπή (EC), το bimekizumab θα είναι η πρώτη εγκεκριμένη θεραπεία που είναι σχεδιασμένη για να αναστέλλει επιλεκτικά τόσο την IL-17A όσο και την IL-17F. Η Ευρωπαϊκή Επιτροπή (EC) αναμένεται να εκδώσει την απόφαση της σχετικά με την άδεια κυκλοφορίας του bimekizumab, με την εμπορική ονομασία BIMZELX®*, σε περίπου 2 μήνες.
H UCB, μία βιοφαρμακευτική εταιρεία με παρουσία σε όλο τον κόσμο ανακοίνωσε ότι η επιτροπή του Ευρωπαϊκού Οργανισμού Φαρμάκων (ΕΜΑ),CHMP, γνωμοδότησε θετικά για τη χορήγηση άδειας κυκλοφορίας για το BIMZELEX®* (bimekizumab), έναν υπό διερεύνηση εκλεκτικό αναστολέα των IL-17A και IL-17F, για τη θεραπεία ενηλίκων ασθενών με μέτρια ως σοβαρή Ψωρίαση κατά Πλάκας, που είναι υποψήφιοι για θεραπεία με συστηματική αγωγή.
«Αυτή η θετική γνωμοδότηση του CHMP αποτελεί σημαντικό ρυθμιστικό ορόσημο για την έγκριση του bimekizumab στην Ευρώπη. Είμαστε ενθουσιασμένοι με τη σημερινή απόφαση που αναγνωρίζει τη δύναμη του κλινικού μας προγράμματος ανάπτυξης στην Ψωρίαση. Το bimekizumab αποτελεί απόδειξη της δέσμευσης μας για την προώθηση της επιστήμης στην ανοσο-δερματολογία, αντιμετωπίζοντας τις ανεκπλήρωτες ανάγκες των ασθενών και βελτιώνοντας τα αποτελέσματα τους», είπε ο Emmanuel Caeymaex, Εκτελεστικός Αντιπρόεδρος Ανοσολογίας και επικεφαλής ΗΠΑ, UCB.

Η θετική γνωμοδότηση του CHMP υποστηρίζεται από τα αποτελέσματα τριών μελετών Φάσης 3 των – BE VIVID, BE READY και BE SURE – στις οποίες αξιολογήθηκαν η αποτελεσματικότητα και ασφάλεια του bimekizumab σε ασθενείς με μέτρια ως σοβαρή Ψωρίαση κατά πλάκας. Όλες οι μελέτες πέτυχαν όλα τα κύρια και δευτερεύοντα καταληκτικά τους σημεία. Οι ασθενείς που έλαβαν bimekizumab επέδειξαν υψηλότερα ποσοστά πλήρους κάθαρσης δέρματος (PASI 90 και IGA 0/1**) τη 16η εβδομάδα συγκριτικά με όσους έλαβαν adalimumab, εικονικό φάρμακο και ustekinumab. Η κλινική ανταπόκριση που επιτεύχθηκε με το bimekizumab τη 16η εβδομάδα, διατηρήθηκε μέχρι και το χρόνο σε όλες τις μελέτες.
Το πιο κοινό ανεπιθύμητο σύμβαμα που προέκυψε από τη θεραπεία ήταν η ρινοφαρυγγίτιδα η στοματική καντιντίαση και η λοίμωξη του ανώτερου αναπνευστικού.
Εάν χορηγηθεί η άδεια κυκλοφορίας από την Ευρωπαϊκή Επιτροπή (ΕC), το bimekizumab θα είναι η πρώτη εγκεκριμένη θεραπεία για ασθενείς με μέτρια έως σοβαρή Ψωρίαση κατά Πλάκας που έχει σχεδιαστεί για να αναστέλλει επιλεκτικά τις IL-17A και IL-17F, δύο βασικές κυτταροκίνες που καθοδηγούν τις φλεγμονώδεις διαδικασίες. Η θετική γνωμοδότηση από τον CHMP είναι μια επιστημονική σύσταση που κοινοποιείται στην Ευρωπαϊκή Επιτροπή (EC) για την έκδοση απόφασης σχετικά με μια άδεια κυκλοφορίας σε επίπεδο ΕΕ. Η άδεια κυκλοφορίας που εκδίδεται από την Ευρωπαϊκή Επιτροπή (EC) μέσω της κεντρικής διαδικασίας, ισχύει σε όλα τα κράτη μέλη της Ευρωπαϊκής Ένωσης, καθώς και στις χώρες του Ευρωπαϊκού Οικονομικού Χώρου, Ισλανδία, Λιχτενστάιν και Νορβηγία.

Η UCB έχει δεσμευτεί να φέρει το bimekizumab σε όλους τους ασθενείς παγκοσμίως. Το bimekizumab είναι αυτή τη στιγμή υπό αξιολόγηση από την Αμερικανική Υπηρεσία Φαρμάκων και Τροφίμων ( FDA), για τη θεραπεία ενηλίκων με μέτρια έως σοβαρή Ψωρίαση κατά Πλάκας. Η αποτελεσματικότητα και ασφάλεια του bimekizumab αξιολογούνται επίσης σε μελέτες Φάσης 3 στην Ψωριασική Αρθρίτιδα, στην Αγκυλοποιητική Σπονδυλίτιδα, στη μη ραδιογραφικά επιβεβαιωμένη Αξονική Σπονδυλαρθρίτιδα,8 και στη Διαπυητική Ιδρωτανδενίτιδα.
Διαβάστε όλες τις τελευταίες Ειδήσεις για την υγεία από την Ελλάδα και τον ΚόσμοΑκολουθήστε το healthweb.gr στο Google News και μάθετε πρώτοι όλες τις ειδήσεις
Ακολουθήστε το healthweb.gr στο κανάλι μας στο YouTube