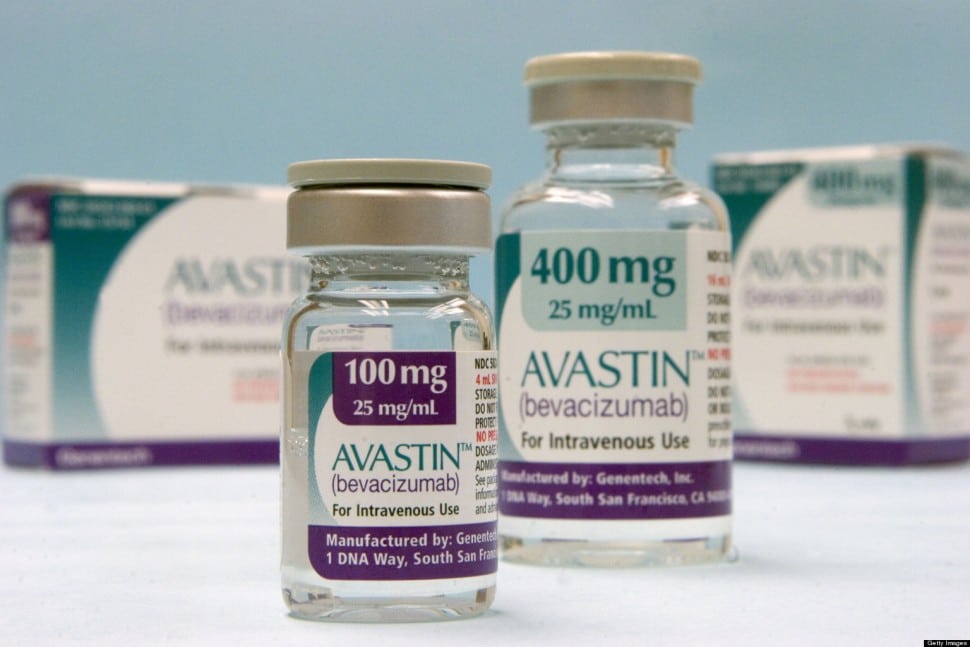
Η γαλλική ρυθμιστική αρχή φαρμάκων και προϊόντων υγείας (ANSM) σε επικοινωνία της με την εταιρία Roche, αιτείται από την ελβετική φαρμακοβιομηχανία πληροφορίες σχετικά με το μη ενδεδειγμένης χρήσης (off-label) Avastin, ένα φάρμακο κατά του καρκίνου των ματιών και για τη θεραπεία της ηλικιακής εκφύλισης της ώχρας κηλίδας.
Σκοπός της γαλλικής αρχής, να αξιοποιήσει δυνητικά το σκεύασμα ως μια φθηνή εναλλακτική θεραπεία του καρκίνου των ματιών, την οποία θα συνταγογραφούν οι γιατροί.
Οι Γάλλοι νομοθέτες ψήφισαν τον Ιούλιο για να επιτραπεί μια τέτοια χρήση του Avastin, αντί του αντίστοιχου Lucentis της Novartis το οποίο είναι πολύ πιο ακριβό.
Παράλληλα, οι επικριτές φοβούνται πως η κίνηση αυτή θα μπορούσε να βάλει την υγεία των ασθενών – και τα κέρδη της εταιρείας – σε κίνδυνο.
Χαρακτηρίστηκα, άλλες φαρμακευτικές εταιρείες και ιατρικοί εμπειρογνώμονες ανησυχούν ότι επιτρέποντας η Γαλλιά τη χρήση ενός φαρμάκου χωρίς επαρκείς κλινικές δοκιμές θα μπορούσε να αυξήσει τους κινδύνους για την υγεία των ασθενών, συμπεριλαμβανομένων των λοιμώξεων.
Στο στάδιο που βρίσκονται τώρα, οι Γαλλικές ρυθμιστικές αρχές ξεκίνησαν τη διαδικασία συγκέντρωσης περισσότερων στοιχείων σχετικά με τα οφέλη και τους κινδύνους από τη χρήση του Avastin αντί του Lucentis για τη θεραπεία της ώχρας κηλίδας (wAMD), που αποτελεί την κύρια αιτία τύφλωσης των ηλικιωμένων.
Οι πληροφορίες που παρέχονται από τη Roche, σε συνδυασμό με ανεξάρτητη έρευνα από την πλευρά του ANSM, θα εξεταστούν στις αρχές του επόμενου έτους από μια ειδική επιτροπή «κινδύνου και όφελους» της ANSM, που αναμένεται να κάνει δημόσια τις συστάσεις της κατά το πρώτο εξάμηνο του 2015.
Το Avastin της Roche δεν έχει εγκριθεί από τις ρυθμιστικές αρχές για την υγεία ως θεραπεία για wAMD, αλλά λειτουργεί με παρόμοιο τρόπο με το Lucentis της Novartis, και άλλα αντίστοιχα φάρμακα φάρμακα που διατίθενται στην αγορά.
Η Γαλλία υποστηρίζει ότι με την ενθάρρυνση της χρήσης του Avastin, το οποίο κοστίζει περίπου 30 φορές λιγότερο από ό, τι εκείνο της Novartis, θα μπορούσε να εξοικονομήσει 200 εκατομμύρια ευρώ (250 εκατομμύρια δολάρια) ετησίως.
Η κίνηση αυτή μπορεί επίσης να οδηγήσει και άλλες ευρωπαϊκές χώρες να ακολουθήσουν το παράδειγμά της Γαλλίας.
Διαβάστε όλες τις τελευταίες Ειδήσεις για την υγεία από την Ελλάδα και τον ΚόσμοΑκολουθήστε το healthweb.gr στο Google News και μάθετε πρώτοι όλες τις ειδήσεις
Ακολουθήστε το healthweb.gr στο κανάλι μας στο YouTube