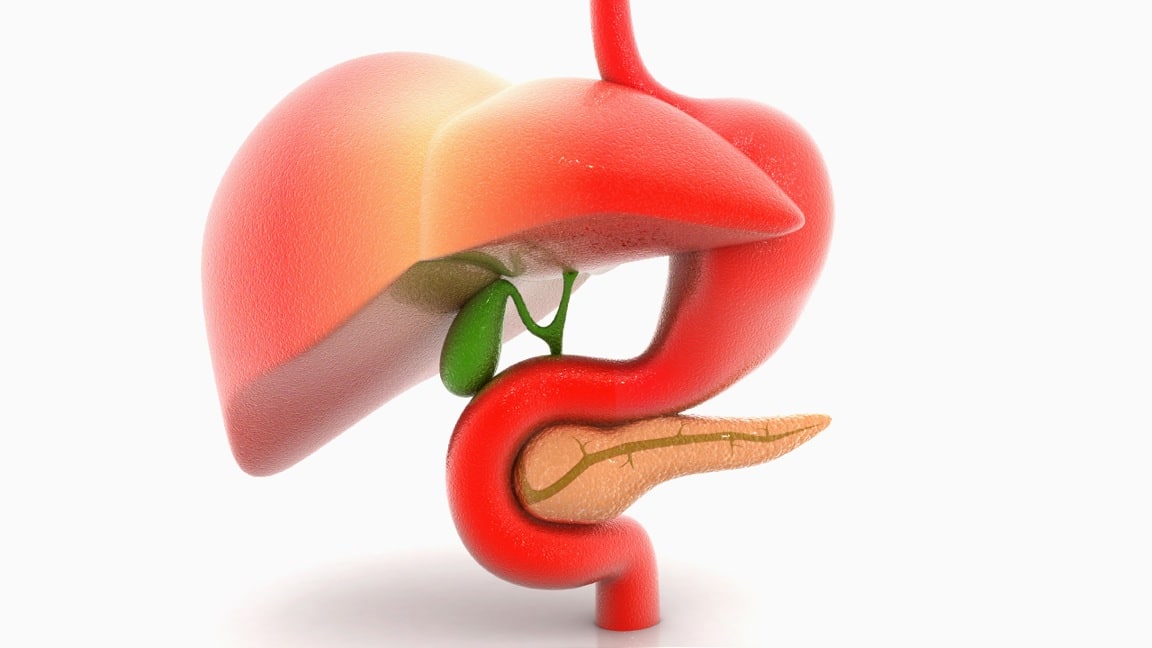
Ο μεταστατικός καρκίνος του παγκρέατος είναι η 4η αιτία θανάτου,με ποσοστό άνω του 95% των ασθενών να καταλήγουν από τη νόσο σε χρονικό διάστημα από 3 έως 6 μήνες .
Στην αντιμετώπιση του παγκρεατικού καρκίνου υπήρχε ένα μεγάλο κενό οποίο έρχεται να καλύψει μία νέα συνδυαστική θεραπεία nab-πακλιταξέλης και γεμσιταβίνης και στην Ελλάδα από την GENESIS Pharma .
Πρόκειται για την πρώτη θεραπεία που λαμβάνει έγκριση μετά από επτά χρόνια και συνδυάζει καλό προφίλ αποτελεσματικότητας και ασφάλειας. Το νέο φάρμακο για τον μεταστατικό καρκίνο του παγκρέατος κυκλοφορεί ήδη στην Ελλάδα και σηματοδοτεί μια μεγάλη επιστημονική πρόοδο των τελευταίων ετών για τη νόσο.
Η άδεια κυκλοφορίας που έλαβε από τον FDA (Food and Drug Administration) και την Ευρωπαϊκή Επιτροπή βασίστηκε στα αποτελέσματα της έρευνας MPACT, μίας από τις μεγαλύτερες πολυκεντρικές παγκόσμιες μελέτες, καθώς σε αυτή συμμετείχαν περισσότεροι από 850 ασθενείς με μεταστατικό καρκίνο του παγκρέατος από 151 κέντρα 11 χωρών, στη Β. Αμερική, την Ευρώπη και την Αυστραλία. Σύμφωνα με τη μελέτη, ο χημειοθεραπευτικός συνδυασμός nab-πακλιταξέλης και γεμσιταβίνης, μπορεί να μειώσει τον κίνδυνο θνησιμότητας κατά 28% σε σχέση με τη γεμσιταβίνη ως μονοθεραπεία. Επιπρόσθετα, η MPACT κατέδειξε ότι αυξήθηκε κατά 60% το ποσοστό των ασθενών που επιβίωσαν τον πρώτο χρόνο, ενώ το ποσοστό για 2 χρόνια επιβίωσης, διπλασιάστηκε.Έγκριση ως θεραπεία πρώτης γραμμής για τον μετασταστικό καρκίνο του παγκρέατος, σε συνδυασμό με την γεμσιταβίνη, έλαβε από τον FDA τον Σεπτέμβριο του 2013 και από την Ευρωπαϊκή Επιτροπή 3 μήνες μετά.
Διαβάστε όλες τις τελευταίες Ειδήσεις για την υγεία από την Ελλάδα και τον ΚόσμοΑκολουθήστε το healthweb.gr στο Google News και μάθετε πρώτοι όλες τις ειδήσεις
Ακολουθήστε το healthweb.gr στο κανάλι μας στο YouTube