Της Νικολέτας Ντάμπου
Γενόσημο φάρμακο για την θεραπεία των ασθενών , ενήλικες και παιδιά που πάσχουν από εστιακές επιληπτικές κρίσεις έλαβε άδεια κυκλοφορίας
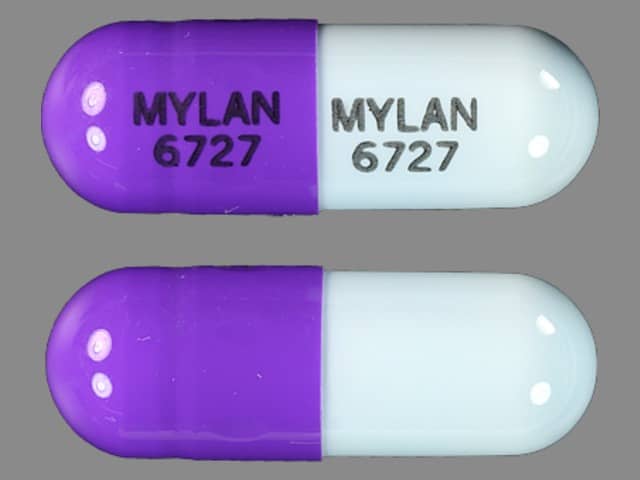
Άδεια κυκλοφορίας στην Ευρωπαϊκή Ένωση εξασφάλισε το φάρμακο Zonisamide Mylan, της γαλλικής εταιρείας Mylan S.A.S., που χρησιμοποιείται για τη θεραπεία ασθενών οι οποίοι πάσχουν από εστιακές επιληπτικές κρίσεις (επιληπτικές κρίσεις που εκδηλώνονται σε ένα μέρος του εγκεφάλου), συμπεριλαμβανομένων των ασθενών με δευτερογενή γενίκευση (περιπτώσεις όπου η κρίση στη συνέχεια εξαπλώνεται σε ολόκληρο τον εγκέφαλο).
Το Zonisamide Mylan χορηγείται ως μονοθεραπεία σε νεοδιαγνωσθέντες ενήλικες και ως πρόσθετη θεραπεία σε ενήλικες και παιδιά ηλικίας 6 ετών και άνω που ήδη λαμβάνουν άλλα αντιεπιληπτικά φάρμακα. Το Zonisamide Mylan είναι «γενόσημο φάρμακο». Αυτό σημαίνει ότι το Zonisamide Mylan είναι παρόμοιο με το «φάρμακο αναφοράς» που είναι ήδη εγκεκριμένο στην ΕΕ και ονομάζεται Zonegran. Το Zonisamide Mylan περιέχει τη δραστική ουσία ζονισαμίδη.
Πώς χρησιμοποιείται το Zonisamide Mylan;
Το φάρμακο χορηγείται μόνο με ιατρική συνταγή και διατίθεται σε καψάκια (25, 50 και 100 mg). Όταν το Zonisamide Mylan χορηγείται ως μονοθεραπεία σε νεοδιαγνωσθέντες ενήλικες, η συνιστώμενη αρχική δόση είναι 100 mg μία φορά ημερησίως για δύο εβδομάδες, η οποία μπορεί να αυξάνεται κατά 100 mg ανά διαστήματα δύο εβδομάδων. Η συνήθης δόση συντήρησης είναι 300 mg ημερησίως.
Όταν το Zonisamide Mylan χρησιμοποιείται σε ενήλικες ως πρόσθετη αγωγή σε υπάρχουσα θεραπεία, η συνιστώμενη αρχική δόση είναι 25 mg δύο φορές ημερησίως. Μετά από μία ή δύο εβδομάδες, η δόση μπορεί να αυξηθεί στα 50 mg δύο φορές ημερησίως και, στη συνέχεια, να αυξάνεται περαιτέρω βαθμιαία κατά 100 mg κάθε εβδομάδα ή κάθε δεύτερη εβδομάδα, ανάλογα με την απόκριση του ασθενούς. Το Zonisamide Mylan μπορεί να χορηγείται μία ή δύο φορές ημερησίως αφού επιτευχθεί η κατάλληλη δόση. Η συνήθης δόση συντήρησης κυμαίνεται από 300 mg έως 500 mg ημερησίως.
Όταν το Zonisamide Mylan χορηγείται σε παιδιά ηλικίας 6 ετών και άνω ως πρόσθετη αγωγή σε ήδη υπάρχουσα θεραπεία, η δόση εξαρτάται από το σωματικό βάρος. Η συνιστώμενη αρχική δόση είναι 1 mg ανά κιλό σωματικού βάρους ημερησίως. Μετά από μία ή δύο εβδομάδες, η ημερήσια δόση μπορεί να αυξάνεται βαθμιαία κατά 1 mg ανά κιλό σωματικού βάρους κάθε μία ή δύο εβδομάδες έως ότου επιτευχθεί η κατάλληλη δόση. Η συνήθης δόση συντήρησης κυμαίνεται από 300 mg έως 500 mg την ημέρα για παιδιά που ζυγίζουν περισσότερο από 55 κιλά και 6 έως 8 mg ανά κιλό σωματικού βάρους για παιδιά που ζυγίζουν λιγότερο από 55 κιλά.
Οι προσαυξήσεις της δόσης ενδέχεται να πρέπει να είναι λιγότερο συχνές σε ασθενείς με ηπατικά ή νεφρικά προβλήματα ή σε όσους λαμβάνουν ορισμένα άλλα φάρμακα. Πριν από τη διακοπή της θεραπείας με Zonisamide Mylan, η δόση θα πρέπει να μειώνεται σταδιακά.
Πώς δρα το Zonisamide Mylan;
Η δραστική ουσία του Zonisamide Mylan, η ζονισαμίδη, είναι ένα αντιεπιληπτικό. Οι επιληπτικές κρίσεις προκαλούνται από τη μη φυσιολογική ηλεκτρική δραστηριότητα του εγκεφάλου. Το Zonisamide θεωρείται ότι δρα αναστέλλοντας συγκεκριμένους πόρους στην επιφάνεια των νευρικών κυττάρων, οι οποίοι ονομάζονται δίαυλοι νατρίου και δίαυλοι ασβεστίου, μέσω των οποίων το νάτριο ή το ασβέστιο εισέρχεται φυσιολογικά στα νευρικά κύτταρα. Όταν το ασβέστιο και το νάτριο εισέρχονται στα νευρικά κύτταρα, είναι δυνατή η μεταβίβαση ηλεκτρικών παλμών μεταξύ των νευρικών κυττάρων. Μέσω της αναστολής αυτών των διαύλων, η ζονισαμίδη αναμένεται να αποτρέψει τη μη φυσιολογική
ηλεκτρική δραστηριότητα που εξαπλώνεται μέσω του εγκεφάλου, μειώνοντας με αυτόν τον τρόπο την πιθανότητα μιας επιληπτικής κρίσης. Το Zonisamide Mylan επιδρά επίσης στον νευροδιαβιβαστή γ–αµινοβουτυρικό οξύ (GABA, μια χημική ουσία που επιτρέπει στα νευρικά κύτταρα να επικοινωνούν μεταξύ τους). Η δράση αυτή μπορεί να βοηθήσει στην σταθεροποίηση της ηλεκτρικής δραστηριότητας στον εγκέφαλο.
Για ποιους λόγους εγκρίθηκε το Zonisamide Mylan;
Η Επιτροπή Φαρμάκων για Ανθρώπινη Χρήση (CHMP) έκρινε ότι, σύμφωνα με τις απαιτήσεις της ΕΕ, έχει αποδειχθεί ότι το Zonisamide Mylan είναι συγκρίσιμης ποιότητας και βιοϊσοδύναμο με το Zonegran. Ως εκ τούτου, όπως ισχύει για το Zonegran, η CHMP έκρινε ότι τα οφέλη του φαρμάκου υπερτερούν των διαπιστωθέντων κινδύνων που συνδέονται με αυτό.
Ανεπιθύμητες ενέργειες
Οι πιο συχνές ανεπιθύμητες ενέργειες σε ελεγχόμενες μελέτες πρόσθετης θεραπείας ήταν υπνηλία, ζάλη και ανορεξία. Οι πιο συχνές ανεπιθύμητες ενέργειες σε μια τυχαιοποιημένη δοκιμή ήταν μειωμένο διττανθρακικό, μειωμένη όρεξη και μειωμένο σωματικό βάρος.
Ακολουθήστε το healthweb.gr στο Google News και μάθετε πρώτοι όλες τις ειδήσεις
Ακολουθήστε το healthweb.gr στο κανάλι μας στο YouTube