Θετική γνωμοδότηση για τη χορήγηση άδειας κυκλοφορίας του cemiplimab, εξέδωσε η Επιτροπή Φαρμακευτικών Προϊόντων για Ανθρώπινη Χρήση (CHMP) του Ευρωπαϊκού Οργανισμού Φαρμάκων (EMA).
Η Επιτροπή Φαρμακευτικών Προϊόντων για Ανθρώπινη Χρήση (CHMP) πρότεινε την υπό όρους έγκρισή του για τη θεραπεία ενηλίκων ασθενών με μεταστατικό ή τοπικά προχωρημένο πλακώδες καρκίνωμα του δέρματος (CSCC) οι οποίοι δεν έχουν κριθεί κατάλληλοι για θεραπευτική χειρουργική επέμβαση ή θεραπευτική ακτινοθεραπεία.
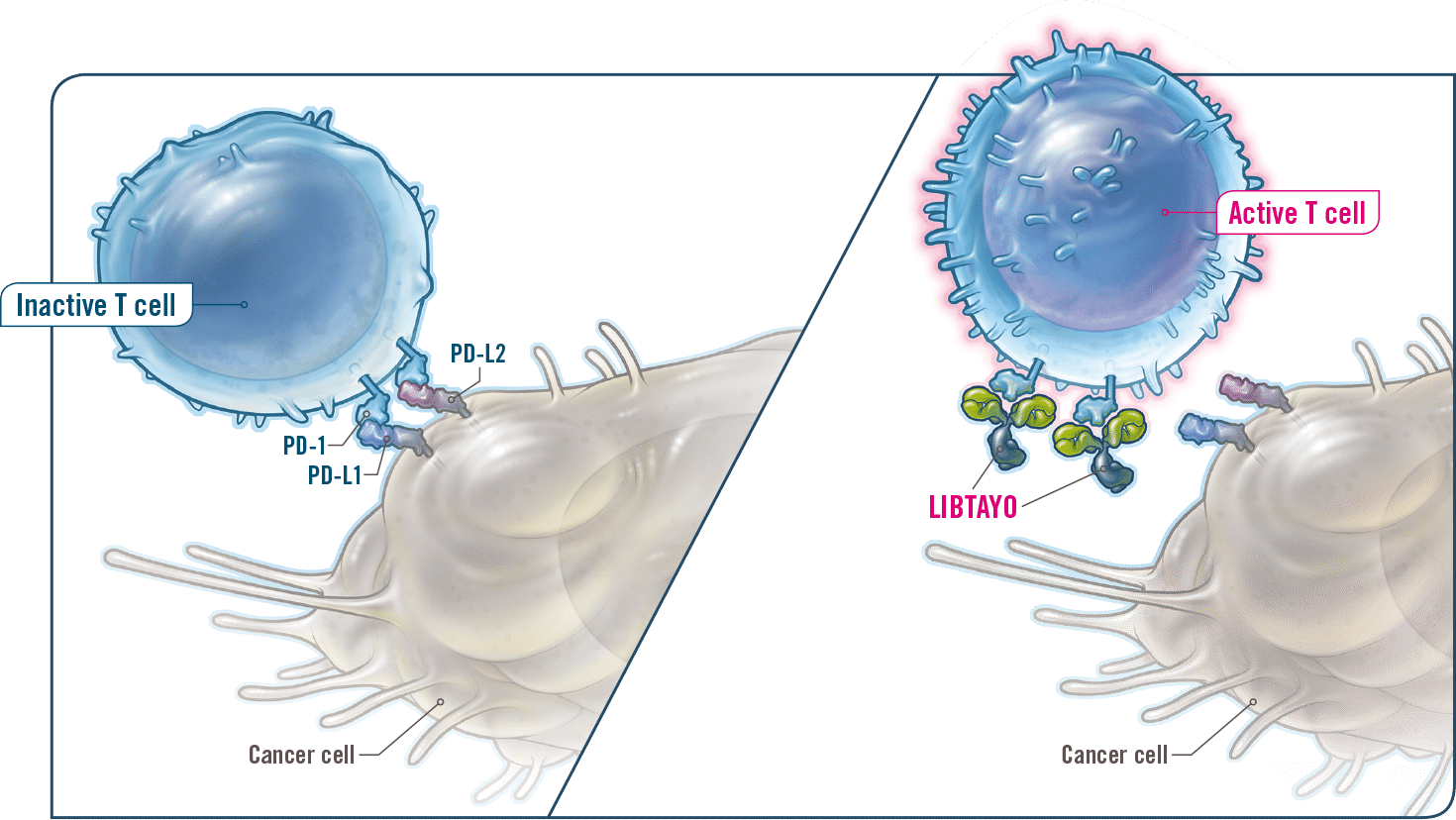
Το cemiplimab είναι ένα πλήρως ανθρώπινο μονοκλωνικό αντίσωμα που στοχεύει τον υποδοχέα της πρωτεΐνης προγραμματισμένου κυτταρικού θανάτου PD-1 (programmed cell death protein-1). Εφόσον εγκριθεί, το cemiplimab θα αποτελέσει την πρώτη και μοναδική εγκεκριμένη θεραπεία για συγκεκριμένους ασθενείς με προχωρημένο πλακώδες καρκίνωμα του δέρματος στην Ευρωπαϊκή Ένωση.
Το πλακώδες καρκίνωμα του δέρματος είναι μία από τις πιο συχνά διαγνωσμένες μορφές καρκίνου του δέρματος παγκοσμίως. Στην Ευρώπη, το πλακώδες καρκίνωμα του δέρματος έχει συχνότητα εμφάνισης διπλάσια από αυτή του μελανώματος, ενώ η επίπτωσή του εκτιμάται ότι αυξάνεται σε σημαντικό βαθμό σε ορισμένες χώρες. Παρόλο που η πρόγνωση για την πλειοψηφία των ασθενών με πλακώδες καρκίνωμα του δέρματος είναι καλή εφόσον η διάγνωση πραγματοποιηθεί σε πρώιμο στάδιο, η νόσος μπορεί να είναι ιδιαίτερα δύσκολο να αντιμετωπιστεί όταν εξελιχθεί σε προχωρημένα στάδια. Το προχωρημένο πλακώδες καρκίνωμα του δέρματος περιλαμβάνει ασθενείς με τοπικά προχωρημένη νόσο (όταν ο καρκίνος διεισδύει σε βαθύτερα στρώματα του δέρματος ή παρακείμενους ιστούς) και ασθενείς με μεταστατική νόσο (όταν ο καρκίνος έχει εξαπλωθεί σε άλλα σημεία του σώματος).
Η γνωμοδότηση της Επιτροπής Φαρμακευτικών Προϊόντων για Ανθρώπινη Χρήση (CHMP) βασίζεται σε δεδομένα από την εγκριτική μελέτη, ανοιχτής σήμανσης, πολυκεντρική, μη τυχαιοποιημένη κλινική μελέτη Φάσης 2 EMPOWER-CSCC-1 (Μελέτη 1540) και υποστηρίζεται από δύο κοορτές επέκτασης, από μία πολυκεντρική, ανοιχτής σήμανσης, μη τυχαιοποιημένη κλινική μελέτη Φάσης 1 στο προχωρημένο πλακώδες καρκίνωμα του δέρματος. Μαζί, οι μελέτες αντιπροσωπεύουν το μεγαλύτερο σύνολο προοπτικών δεδομένων ασθενών με προχωρημένο πλακώδες καρκίνωμα του δέρματος.
Στο πλαίσιο της έγκρισης υπό όρους, η Regeneron και η Sanofi θα πρέπει να υποβάλλουν επιπρόσθετα δεδομένα από τη μελέτη EMPOWER-CSCC-1, συμπεριλαμβανομένων των αποτελεσμάτων από μια ομάδα που προστέθηκε πρόσφατα στη μελέτη, προκειμένου να επιβεβαιωθεί περαιτέρω το προφίλ οφέλους-κινδύνου του cemiplimab. Η Ευρωπαϊκή Επιτροπή αναμένεται να λάβει την τελική απόφαση σχετικά με την αίτηση για το cemiplimab τους επόμενους μήνες.
Το cemiplimab αναπτύσσεται από κοινού από τη Regeneron και τη Sanofi στο πλαίσιο μιας συμφωνίας παγκόσμιας συνεργασίας.
Διαβάστε όλες τις τελευταίες Ειδήσεις για την υγεία από την Ελλάδα και τον Κόσμο
Ακολουθήστε το healthweb.gr στο Google News και μάθετε πρώτοι όλες τις ειδήσεις
Ακολουθήστε το healthweb.gr στο κανάλι μας στο YouTube