Η αίτηση άδειας κυκλοφορίας για το Dupilumab έγινε δεκτή προς εξέταση από τον Ευρωπαϊκό Οργανισμό Φαρμάκων .
Η Sanofi και η Regeneron Pharmaceuticals, Inc. ανακοίνωσαν σήμερα ότι ο Ευρωπαϊκός Οργανισμός Φαρμάκων (EMA) αποδέχτηκε προς εξέταση την Αίτηση Άδειας Κυκλοφορίας (MAA) για το dupilumab για τη θεραπεία ενηλίκων με μέτρια έως σοβαρή ατοπική δερματίτιδα (ΑΔ), οι οποίοι είναι κατάλληλοι για να λάβουν συστηματική θεραπεία. Η υπό έρευνα βιολογική θεραπεία dupilumab αναστέλλει τον σηματοδοτικό μηχανισμό των IL-4 και IL-13, δύο βασικών κυτοκινών που απαιτούνται για την ανοσολογική απάντηση τύπου 2 (συμπεριλαμβανομένης της Th2), η οποία πιστεύεται ότι αποτελεί σημαντικό παράγοντα στην παθογένεια της νόσου.
Η Αίτηση Άδειας Κυκλοφορίας (MAA) για το dupilumab βασίζεται σε στοιχεία από τρεις πιλοτικές μελέτες Φάσης 3 από το παγκόσμιο πρόγραμμα LIBERTY AD που περιλαμβάνει περισσότερους από 2.500 ασθενείς. Στόχος των μελετών ήταν να αξιολογηθεί το dupilumab ως μονοθεραπεία (SOLO 1 και SOLO 2) και σε ταυτόχρονη χορήγηση με τοπικά κορτικοστεροειδή (CHRONOS) σε ενήλικες ασθενείς με μέτρια έως σοβαρή ΑΔ οι οποίοι δεν ελέγχονται επαρκώς με συνταγογραφούμενες θεραπείες που εφαρμόζονται τοπικά.
Η Αίτηση για Άδεια Βιολογικού Προϊόντος (BLA) για το dupilumab έγινε αποδεκτή προς εξέταση κατά προτεραιότητα από τον Οργανισμό Τροφίμων και Φαρμάκων των ΗΠΑ (FDA) τον Σεπτέμβριο του 2016. Βάσει του Νόμου περί Συνταγογράφησης Φαρμάκων (PDUFA), η καταληκτική ημερομηνία αξιολόγησης είναι η 29η Μαρτίου, 2017.
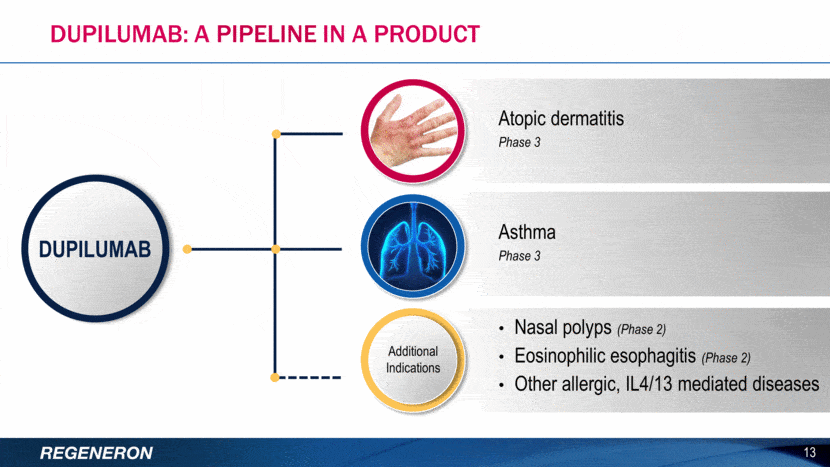
Το dupilumab επί του παρόντος βρίσκεται υπό κλινική ανάπτυξη και η ασφάλεια και αποτελεσματικότητά του δεν έχουν αξιολογηθεί πλήρως από καμία ρυθμιστική αρχή. Εκτός από την ΑΔ σε ενήλικες, το dupilumab μελετάται για τη θεραπεία της ΑΔ σε παιδιά, του άσθματος, της ρινικής πολυποδίασης και της ηωσινοφιλικής οισοφαγίτιδας. Εφόσον εγκριθεί, το dupilumab θα διατεθεί στην αγορά από τη Regeneron και τη Sanofi Genzyme, την παγκόσμια επιχειρησιακή μονάδα ειδικής φροντίδας της Sanofi.
Διαβάστε όλες τις τελευταίες Ειδήσεις για την υγεία από την Ελλάδα και τον ΚόσμοΑκολουθήστε το healthweb.gr στο Google News και μάθετε πρώτοι όλες τις ειδήσεις
Ακολουθήστε το healthweb.gr στο κανάλι μας στο YouTube